तेजी से, दवा डेवलपर्स बड़े अणुओं, विशेष रूप से प्रोटीन को चिकित्सीय विकल्प के रूप में देख रहे हैं। एक प्रोटीन दवा उत्पाद का निर्माण काफी चुनौती भरा हो सकता है, और प्रोटीन संरचना की प्रकृति की अच्छी समझ के बिना और विशिष्ट प्रोटीन की संरचना संबंधी विशेषताओं को तैयार किए बिना, परिणाम विनाशकारी हो सकते हैं।
इस तकनीकी संक्षिप्त का उद्देश्य पाठक को प्रोटीन संरचना का त्वरित अवलोकन देना है। यह संक्षेप में यह भी कवर करेगा कि निर्माण के दौरान प्रोटीन संरचना कैसे प्रभावित हो सकती है और कुछ विश्लेषणात्मक तरीके जिनका उपयोग संरचना को निर्धारित करने और प्रोटीन की स्थिरता का विश्लेषण करने के लिए किया जा सकता है।
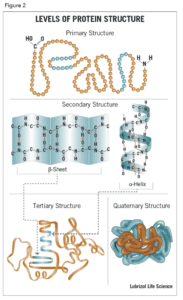
शब्द, संरचना, जब प्रोटीन के संबंध में प्रयोग किया जाता है, छोटे अणुओं की तुलना में कहीं अधिक जटिल अर्थ लेता है। प्रोटीन मैक्रोमोलेक्यूल्स होते हैं और इनकी संरचना के चार अलग-अलग स्तर होते हैं – प्राथमिक, द्वितीयक, तृतीयक और चतुर्धातुक।
प्राथमिक संरचना
प्रोटीन निर्माण के लिए कोशिकाओं द्वारा उपयोग किए जाने वाले 20 अलग-अलग मानक एल-α-एमिनो एसिड होते हैं। अमीनो एसिड, जैसा कि उनके नाम से संकेत मिलता है | प्रोटीन में एक मूल अमीनो समूह और एक अम्लीय कार्बोक्सिल समूह दोनों होते हैं।
यह भिन्नता व्यक्तिगत अमीनो एसिड को पेप्टाइड बॉन्ड बनाकर लंबी श्रृंखलाओं में शामिल होने की अनुमति देती है। एक एमिनो एसिड के -NH2 और दूसरे के -COOH के बीच 50 से कम अमीनो एसिड वाले अनुक्रमों को आम तौर पर पेप्टाइड्स कहा जाता है, जबकि शब्द, प्रोटीन और पॉलीपेप्टाइड, लंबे अनुक्रमों के लिए उपयोग किए जाते हैं।
एक प्रोटीन एक या एक से अधिक पॉलीपेप्टाइड अणुओं से बना हो सकता है। मुक्त कार्बोक्सिल समूह के साथ पेप्टाइड या प्रोटीन अनुक्रम के अंत को कार्बोक्सी-टर्मिनस या सी-टर्मिनस कहा जाता है।
शब्द, एमिनो-टर्मिनस और एन-टर्मिनस, एक मुक्त α-amino समूह के साथ अनुक्रम के अंत का वर्णन करते हैं।
अमीनो एसिड उनकी साइड चेन पर प्रतिस्थापन द्वारा संरचना में भिन्न होते हैं। ये साइड चेन अंतिम पेप्टाइड या प्रोटीन को विभिन्न रासायनिक, भौतिक और संरचनात्मक गुण प्रदान करते हैं।
आमतौर पर प्रोटीन में पाए जाने वाले 20 अमीनो एसिड की संरचनाएं चित्र 1 में दिखाई गई हैं। प्रत्येक अमीनो एसिड में एक-अक्षर और तीन-अक्षर दोनों का संक्षिप्त नाम होता है।
इन संक्षिप्ताक्षरों का उपयोग आमतौर पर पेप्टाइड या प्रोटीन के लिखित अनुक्रम को सरल बनाने के लिए किया जाता है।
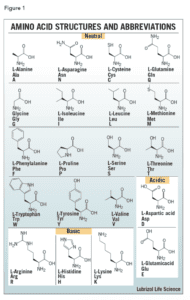
साइड-चेन प्रतिस्थापन के आधार पर, एक एमिनो एसिड को अम्लीय, मूल या तटस्थ होने के रूप में वर्गीकृत किया जा सकता है। यद्यपि मनुष्यों में पाए जाने वाले विभिन्न प्रोटीनों के संश्लेषण के लिए 20 अमीनो एसिड की आवश्यकता होती है, हम केवल दस का ही संश्लेषण कर सकते हैं। शेष 10 को आवश्यक अमीनो एसिड कहा जाता है और इसे आहार में प्राप्त करना चाहिए।
एक प्रोटीन का अमीनो एसिड अनुक्रम डीएनए में एन्कोडेड होता है। प्रोटीन को चरणों की एक श्रृंखला द्वारा संश्लेषित किया जाता है जिसे ट्रांसक्रिप्शन कहा जाता है (एक मानार्थ संदेशवाहक आरएनए स्ट्रैंड – एमआरएनए बनाने के लिए डीएनए स्ट्रैंड का उपयोग) और अनुवाद (एमआरएनए अनुक्रम का उपयोग अमीनो एसिड की श्रृंखला के संश्लेषण को निर्देशित करने के लिए एक टेम्पलेट के रूप में किया जाता है) प्रोटीन ऊपर)।
अक्सर, पोस्ट-ट्रांसलेशन संबंधी संशोधन, जैसे ग्लाइकोसिलेशन या फॉस्फोराइलेशन, होते हैं जो प्रोटीन के जैविक कार्य के लिए आवश्यक होते हैं। जबकि अमीनो एसिड अनुक्रम प्रोटीन की प्राथमिक संरचना बनाता है, प्रोटीन के रासायनिक/जैविक गुण त्रि-आयामी या तृतीयक संरचना पर बहुत अधिक निर्भर होते हैं।
द्वितियक संरचना
प्रोटीन या पेप्टाइड्स के खिंचाव या स्ट्रैंड में हाइड्रोजन बॉन्डिंग पर निर्भर विशिष्ट, विशिष्ट स्थानीय संरचनात्मक संरचना या द्वितीयक संरचना होती है। माध्यमिक संरचना के दो मुख्य प्रकार α-हेलिक्स और ß-शीट हैं।
α-हेलिक्स एक दाहिने हाथ का कुंडलित किनारा है। एक α-हेलिक्स में अमीनो एसिड समूहों के पार्श्व-श्रृंखला प्रतिस्थापन बाहर तक फैले हुए हैं।
हाइड्रोजन बांड स्ट्रैंड में प्रत्येक C=O बांड के ऑक्सीजन और हेलिक्स में प्रत्येक NH समूह के चार अमीनो एसिड के नीचे बनते हैं। हाइड्रोजन बांड इस संरचना को विशेष रूप से स्थिर बनाते हैं। अमीनो एसिड के साइड-चेन प्रतिस्थापन एनएच समूहों के बगल में फिट होते हैं।
-शीट में हाइड्रोजन बॉन्डिंग स्ट्रैंड्स (इंटर-स्ट्रैंड) के बजाय स्ट्रैंड्स (इंटर-स्ट्रैंड) के बीच होती है। शीट संरचना में अगल-बगल पड़ी हुई किस्में के जोड़े होते हैं। एक स्ट्रैंड में कार्बोनिल ऑक्सीजेंस आसन्न स्ट्रैंड के अमीनो हाइड्रोजेन के साथ बंध जाता है। स्ट्रैंड दिशाएं (एन-टर्मिनस से सी-टर्मिनस) समान या विपरीत हैं या नहीं, इस पर निर्भर करते हुए दो स्ट्रैंड या तो समानांतर या विरोधी-समानांतर हो सकते हैं। अधिक अच्छी तरह से संरेखित हाइड्रोजन बांड के कारण विरोधी समानांतर ß-शीट अधिक स्थिर है।
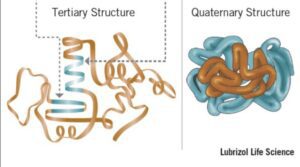
तृतीयक संरचना
प्रोटीन अणु का समग्र त्रि-आयामी आकार तृतीयक संरचना है। प्रोटीन अणु इस तरह से झुकेगा और मुड़ेगा कि अधिकतम स्थिरता या न्यूनतम ऊर्जा अवस्था प्राप्त हो सके। यद्यपि एक प्रोटीन का त्रि-आयामी आकार अनियमित और यादृच्छिक लग सकता है, यह अमीनो एसिड के साइड-चेन समूहों के बीच संबंधों के संबंध के कारण कई स्थिर बलों द्वारा निर्मित होता है।
शारीरिक स्थितियों के तहत, तटस्थ, गैर-ध्रुवीय अमीनो एसिड जैसे फेनिलएलनिन या आइसोल्यूसीन की हाइड्रोफोबिक साइड-चेन प्रोटीन अणु के आंतरिक भाग पर दब जाती है, जिससे उन्हें जलीय माध्यम से बचाया जाता है।
ऐलेनिन, वेलिन, ल्यूसीन और आइसोल्यूसीन के एल्काइल समूह अक्सर एक दूसरे के बीच हाइड्रोफोबिक इंटरैक्शन बनाते हैं, जबकि फेनिलएलनिन और टाइरोसिन जैसे सुगंधित समूह अक्सर एक साथ ढेर हो जाते हैं। एसिडिक या बेसिक अमीनो एसिड साइड-चेन आमतौर पर प्रोटीन की सतह पर उजागर होते हैं क्योंकि वे हाइड्रोफिलिक होते हैं।
सिस्टीन पर सल्फहाइड्रील समूहों के ऑक्सीकरण द्वारा डाइसल्फ़ाइड पुलों का निर्माण प्रोटीन तृतीयक संरचना के स्थिरीकरण का एक महत्वपूर्ण पहलू है, जिससे प्रोटीन श्रृंखला के विभिन्न भागों को सहसंयोजक रूप से एक साथ रखा जा सकता है। इसके अतिरिक्त, विभिन्न पार्श्व-श्रृंखला समूहों के बीच हाइड्रोजन बांड बन सकते हैं।
डाइसल्फ़ाइड पुलों की तरह, ये हाइड्रोजन बांड एक श्रृंखला के दो हिस्सों को एक साथ ला सकते हैं जो अनुक्रम के संदर्भ में कुछ दूरी पर हैं। नमक पुल, अमीनो एसिड साइड चेन पर सकारात्मक और नकारात्मक चार्ज साइटों के बीच आयनिक इंटरैक्शन भी प्रोटीन की तृतीयक संरचना को स्थिर करने में मदद करते हैं।
चतुर्धातुक संरचना
कई प्रोटीन कई पॉलीपेप्टाइड श्रृंखलाओं से बने होते हैं, जिन्हें अक्सर प्रोटीन सबयूनिट कहा जाता है। ये सबयूनिट एक ही हो सकते हैं, जैसे कि एक होमोडीमर में, या अलग, जैसा कि एक हेटेरोडिमर में होता है।
चतुर्धातुक संरचना से तात्पर्य है कि कैसे ये प्रोटीन उपइकाइयाँ एक-दूसरे के साथ परस्पर क्रिया करती हैं और एक बड़ा समग्र प्रोटीन परिसर बनाने के लिए खुद को व्यवस्थित करती हैं।
प्रोटीन कॉम्प्लेक्स का अंतिम आकार एक बार फिर हाइड्रोजन-बॉन्डिंग, डाइसल्फ़ाइड-ब्रिज और सॉल्ट ब्रिज सहित विभिन्न इंटरैक्शन द्वारा स्थिर हो जाता है। प्रोटीन संरचना के चार स्तरों को चित्र 2 में दिखाया गया है।
प्रोटीन स्थिरता
त्रि-आयामी संरचना को नियंत्रित करने वाले कमजोर अंतःक्रियाओं की प्रकृति के कारण, प्रोटीन बहुत संवेदनशील अणु होते हैं। देशी अवस्था शब्द का प्रयोग प्रोटीन को स्वस्थानी में उसकी सबसे स्थिर प्राकृतिक संरचना का वर्णन करने के लिए किया जाता है।
तापमान, पीएच, पानी को हटाने, हाइड्रोफोबिक सतहों की उपस्थिति, धातु आयनों की उपस्थिति और उच्च कतरनी सहित कई बाहरी तनाव कारकों से यह मूल स्थिति बाधित हो सकती है। तनाव कारक के संपर्क में आने के कारण द्वितीयक, तृतीयक या चतुर्धातुक संरचना के नुकसान को विकृतीकरण कहा जाता है। विकृतीकरण के परिणामस्वरूप प्रोटीन का यादृच्छिक या गलत आकार में प्रकट होना होता है।
एक विकृत प्रोटीन में अपने मूल रूप में प्रोटीन की तुलना में काफी अलग गतिविधि प्रोफ़ाइल हो सकती है, आमतौर पर जैविक कार्य खो देता है। विकृत होने के अलावा, प्रोटीन कुछ तनाव स्थितियों के तहत समुच्चय भी बना सकते हैं।
समुच्चय अक्सर निर्माण प्रक्रिया के दौरान उत्पादित होते हैं और आमतौर पर अवांछनीय होते हैं, मुख्य रूप से उनके द्वारा प्रशासित होने पर प्रतिकूल प्रतिरक्षा प्रतिक्रिया पैदा करने की संभावना के कारण।
प्रोटीन क्षरण के इन भौतिक रूपों के अलावा, प्रोटीन रासायनिक क्षरण के संभावित मार्गों से अवगत होना भी महत्वपूर्ण है। इनमें ऑक्सीकरण, डीमिडेशन, पेप्टाइड-बॉन्ड हाइड्रोलिसिस, डाइसल्फ़ाइड-बॉन्ड फेरबदल और क्रॉस-लिंकिंग शामिल हैं।
प्रसंस्करण और प्रोटीन के निर्माण में उपयोग की जाने वाली विधियों में, किसी भी लियोफिलाइजेशन चरण सहित, गिरावट को रोकने और भंडारण में और दवा वितरण के दौरान प्रोटीन बायोफर्मासिटिकल की स्थिरता को बढ़ाने के लिए सावधानीपूर्वक जांच की जानी चाहिए।
प्रोटीन संरचना विश्लेषण
प्रोटीन संरचना की जटिलताएं सबसे उन्नत विश्लेषणात्मक उपकरणों के साथ भी एक पूर्ण प्रोटीन संरचना को स्पष्ट करना बेहद कठिन बना देती हैं। एक एमिनो एसिड विश्लेषक का उपयोग यह निर्धारित करने के लिए किया जा सकता है कि कौन से एमिनो एसिड मौजूद हैं और प्रत्येक के दाढ़ अनुपात। प्रोटीन के अनुक्रम का विश्लेषण पेप्टाइड मैपिंग और एडमैन डिग्रेडेशन या मास स्पेक्ट्रोस्कोपी के उपयोग के माध्यम से किया जा सकता है। यह प्रक्रिया पेप्टाइड्स और छोटे प्रोटीनों के लिए नियमित है लेकिन बड़े मल्टीमेरिक प्रोटीन के लिए अधिक जटिल हो जाती है।
पेप्टाइड मैपिंग में आम तौर पर विशिष्ट क्लेवाज साइटों पर छोटे पेप्टाइड्स में अनुक्रम को काटने के लिए विभिन्न प्रोटीज एंजाइमों के साथ प्रोटीन का उपचार होता है।
आमतौर पर इस्तेमाल किए जाने वाले दो एंजाइम ट्रिप्सिन और काइमोट्रिप्सिन हैं। मास स्पेक्ट्रोस्कोपी पेप्टाइड फिंगरप्रिंटिंग विधियों और डेटाबेस खोज के माध्यम से एंजाइम डाइजेस्ट प्रोटीन के विश्लेषण के लिए एक अमूल्य उपकरण बन गया है।
एडमैन डिग्रेडेशन में एन-टर्मिनस से शुरू होने वाले शॉर्ट पेप्टाइड से एक समय में एक एमिनो एसिड की दरार, अलगाव और पहचान शामिल है।
एक प्रोटीन की द्वितीयक संरचना को चिह्नित करने के लिए इस्तेमाल की जाने वाली एक विधि है वृत्ताकार द्वैतवाद स्पेक्ट्रोस्कोपी (सीडी)। विभिन्न प्रकार की माध्यमिक संरचना, α-हेलिक्स, ß-शीट और रैंडम कॉइल, सभी में स्पेक्ट्रम के दूर-यूवी क्षेत्र (190-250 एनएम) में विशिष्ट गोलाकार द्विभाजन स्पेक्ट्रा होता है।
इन स्पेक्ट्रा का उपयोग प्रत्येक प्रकार की संरचना से बने संपूर्ण प्रोटीन के अंश का अनुमान लगाने के लिए किया जा सकता है।
एक्स-रे क्रिस्टलोग्राफी या परमाणु चुंबकीय अनुनाद (एनएमआर) विश्लेषण का उपयोग करके प्रोटीन की त्रि-आयामी संरचना का एक अधिक पूर्ण, उच्च-रिज़ॉल्यूशन विश्लेषण किया जाता है। एक्स-रे विवर्तन द्वारा प्रोटीन की त्रि-आयामी संरचना का निर्धारण करने के लिए, एक बड़े, सुव्यवस्थित एकल क्रिस्टल की आवश्यकता होती है।
एक्स-रे विवर्तन परमाणुओं के बीच कम दूरी की माप की अनुमति देता है और एक त्रि-आयामी इलेक्ट्रॉन घनत्व मानचित्र उत्पन्न करता है, जिसका उपयोग प्रोटीन संरचना का एक मॉडल बनाने के लिए किया जा सकता है।
प्रोटीन की त्रि-आयामी संरचना को निर्धारित करने के लिए एनएमआर के उपयोग से एक्स-रे विवर्तन पर कुछ फायदे हैं कि इसे समाधान में किया जा सकता है और इस प्रकार प्रोटीन क्रिस्टल जाली की बाधाओं से मुक्त होता है।
आम तौर पर इस्तेमाल की जाने वाली दो-आयामी एनएमआर तकनीक नोएसवाई हैं, जो अंतरिक्ष के माध्यम से परमाणुओं के बीच की दूरी को मापती है, और सीओईएसवाई, जो बांड के माध्यम से दूरी को मापती है।
प्रोटीन संरचना स्थिरता विश्लेषण
प्रोटीन की स्थिरता को निर्धारित करने के लिए कई अलग-अलग तकनीकों का उपयोग किया जा सकता है। एक प्रोटीन के प्रकटन के विश्लेषण के लिए, प्रतिदीप्ति, यूवी, अवरक्त और सीडी जैसी स्पेक्ट्रोस्कोपिक विधियों का उपयोग किया जा सकता है।
थर्मोडायनामिक तरीके जैसे डिफरेंशियल स्कैनिंग कैलोरीमेट्री (डीएससी) प्रोटीन स्थिरता पर तापमान के प्रभाव को निर्धारित करने में उपयोगी हो सकते हैं।
तुलनात्मक पेप्टाइड-मानचित्रण (आमतौर पर एलसी/एमएस का उपयोग करते हुए) एक प्रोटीन में रासायनिक परिवर्तनों को निर्धारित करने में एक अत्यंत मूल्यवान उपकरण है, जैसे ऑक्सीकरण या डीमिडेशन। एचपीएलसी भी प्रोटीन की शुद्धता का विश्लेषण करने का एक अमूल्य साधन है।
एसडीएस-पेज, आइसो-इलेक्ट्रिक फोकसिंग और केशिका वैद्युतकणसंचलन जैसे अन्य विश्लेषणात्मक तरीकों का भी प्रोटीन स्थिरता निर्धारित करने के लिए उपयोग किया जा सकता है, और एक उपयुक्त बायोसे का उपयोग प्रोटीन बायोफर्मासिटिकल की शक्ति को निर्धारित करने के लिए किया जाना चाहिए।
एकत्रीकरण की स्थिति को “कण” आकार का पालन करके निर्धारित किया जा सकता है और विभिन्न परिस्थितियों में समय के साथ इसका पालन करने के लिए सरणी वाले उपकरण उपलब्ध हैं।
प्रोटीन स्थिरता का निर्धारण करने के तरीकों की विविधता फिर से प्रोटीन संरचना की प्रकृति की जटिलता और एक सफल बायोफर्मासिटिकल उत्पाद के लिए उस संरचना को बनाए रखने के महत्व पर जोर देती है।
संदर्भ
प्रोटीन संरचना, स्थिरता और तह, आणविक जीव विज्ञान में तरीके, 168, केनेथ पी. मर्फी द्वारा संपादित
प्रोटीन स्थिरता और तह, सिद्धांत और व्यवहार, आण्विक जीवविज्ञान में तरीके, वॉल्यूम। 40, ब्रेट शर्ली द्वारा संपादित